Glioma e Glioblastoma
INTRODUZIONE
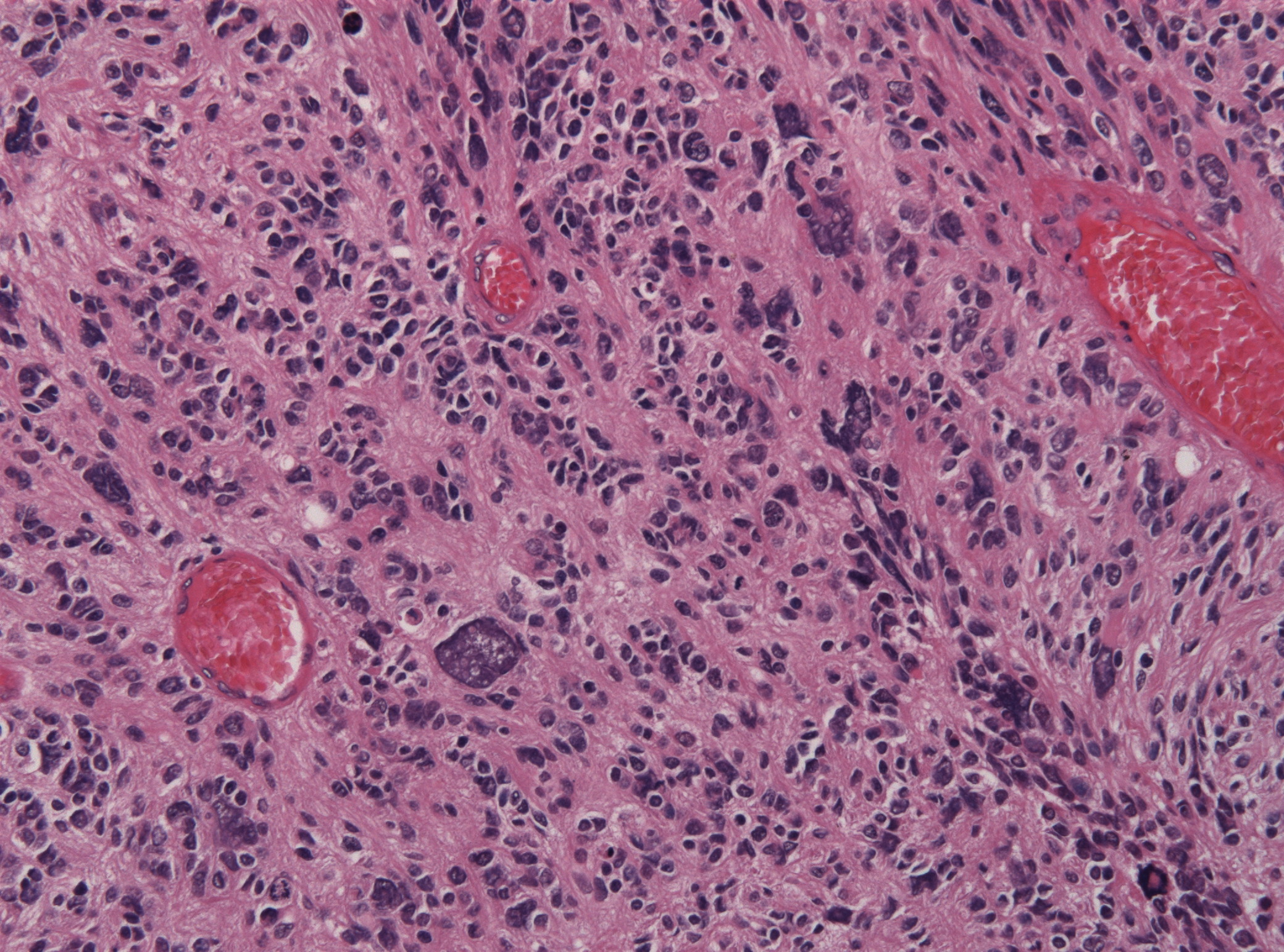
I gliomi sono tumori cerebrali che si sviluppano a partire dalle cellule gliali, le quali svolgono una funzione strutturale nel cervello e di supporto funzionale.
La loro classificazione è evoluta nel tempo, con le scoperte scientifiche sulla genetica dei tumori.
Prima del 2000, i gliomi venivano classificati in base al loro aspetto al microscopio (istologia), ed ulteriormente suddivisi in gradi da 1 a 4 a seconda della loro aggressività microscopica. I gradi 1 e 2 erano considerati “a basso grado”, i gradi 3 e 4 erano considerati “alto grado”.
Dal 2016, e con la nuova definizione del 2021, i gliomi vengono classificati in base non solo all’aspetto istologico, ma anche e soprattutto alla loro composizione genetica.
Classificazione
La moderna classificazione dei gliomi si fonda sulla Classificazione dei tumori del sistema nervoso centrale dell’Organizzazione Mondiale della Sanità (OMS), inizialmente pubblicata nel 1979 e aggiornata cinque volte, l’ultima nel 2021.
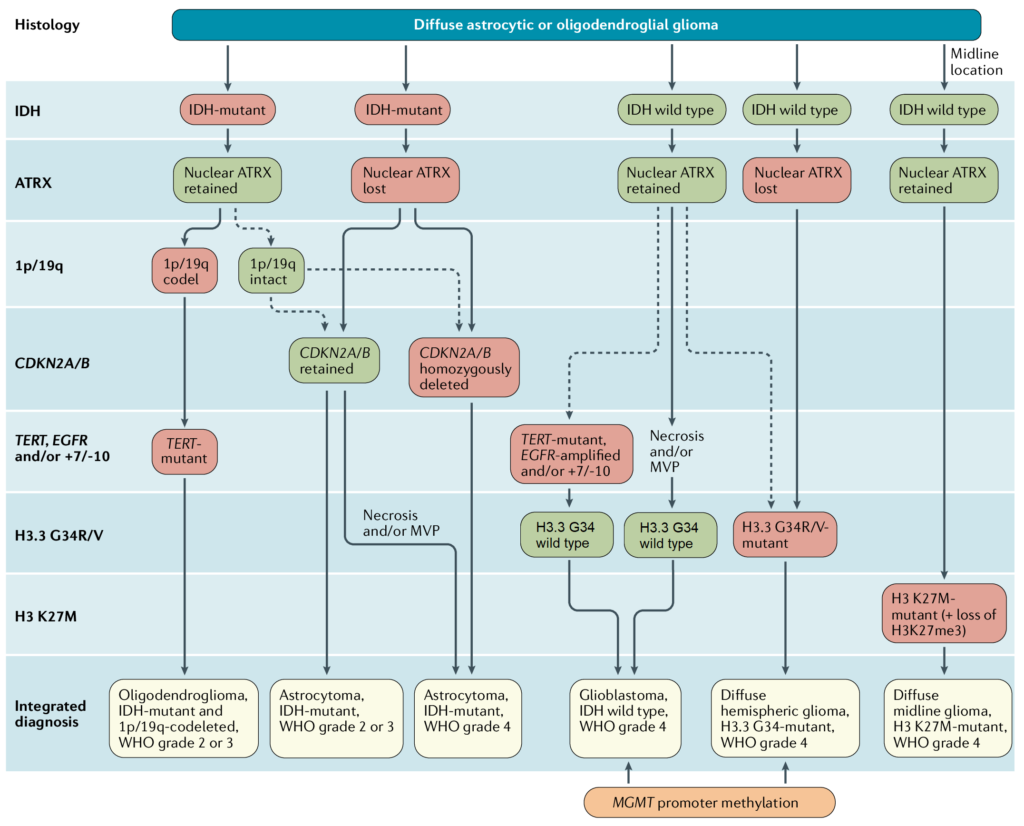
Due importanti varianti genetiche che influenzano la classificazione di un glioma sono la mutazione dell’isocitrato deidrogenasi (IDH) e la “delezione 1p/19q”. Entrambe queste varianti indicano una prognosi più favorevole. In altre parole, le persone con un glioma che presenta una delezione 1p/19q o una mutazione IDH tendono a vivere più a lungo rispetto a chi ha un glioma che appare simile al microscopio ma non possiede queste varianti. Altri cambiamenti genetici hanno l’effetto opposto, portando a riconoscere alcuni tumori precedentemente considerati di basso grado come più simili a quelli di alto grado o maligni.
- Mutazione IDH1/IDH2 — Le mutazioni nell’isocitrato deidrogenasi di tipo 1 (IDH1) e, meno frequentemente, nel tipo 2 (IDH2), sono caratteristiche distintive degli astrocitomi e degli oligodendrogliomi. Queste mutazioni conferiscono una prognosi significativamente migliore rispetto ai tumori con IDH non mutato (IDH-wildtype).
- Codelezione 1p/19q — La perdita completa del braccio di 1p e 19q, dovuta a una traslocazione sbilanciata tra i cromosomi 1 e 19, è una caratteristica tipica dei tumori oligodendrogliali. Questo fenomeno è un forte indicatore di una risposta terapeutica positiva e di una maggiore sopravvivenza.
- Mutazione ATRX — Le mutazioni nel gene regolatore della cromatina, ATRX, sono comunemente riscontrate nei gliomi astrocitici diffusi. Queste mutazioni sono strettamente associate a quelle dei geni IDH1/2 e TP53, e si escludono reciprocamente con la codelezione 1p/19q. Le mutazioni probabilmente rappresentano un evento precoce nella gliomagenesi, fornendo un meccanismo genetico responsabile del mantenimento dei telomeri.
- Mutazione promotore TERT — I glioblastomi sono caratterizzati anche da mutazioni nel promotore del gene TERT, suggerendo un ruolo cruciale del mantenimento dei telomeri nella biologia del glioblastoma. Questo è confermato dall’osservazione che una mutazione del promotore TERT in un glioma astrocitico di tipo IDH-wildtype, anche se istologicamente di grado inferiore, è associata a un comportamento di grado 4.
- Amplificazione e sovraespressione dei fattori di crescita – Numerosi fattori di crescita, noti anche come oncogeni, sono amplificati e/o sovraespressi nei gliomi di alto grado, offrendo così un vantaggio proliferativo alle cellule tumorali. Tra questi, EGFR e PDGF sono stati oggetto di approfonditi studi. L’amplificazione del gene EGFR è correlata a tumori di grado superiore.
- Metilazione del promotore MGMT – MGMT è un enzima chiave nella riparazione del DNA dopo la chemioterapia con agenti alchilanti. Durante lo sviluppo tumorale, il gene MGMT può essere silenziato tramite metilazione del suo promotore, ostacolando così la riparazione del DNA danneggiato e potenziando l’efficacia della chemioterapia alchilante. Numerosi studi clinici hanno dimostrato che la metilazione del promotore MGMT è un fattore prognostico di miglioramento della sopravvivenza.
SINTOMI
I gliomi crescono all’interno del tessuto cerebrale normale, causando sintomi man mano che si sviluppano localmente. Questa crescita può interrompere le connessioni tra le cellule cerebrali normali e creare pressione sulle aree circostanti del cervello. Poiché il cervello è confinato all’interno del cranio, non può espandersi per fare spazio al tumore in crescita. Di conseguenza, anche un tumore relativamente piccolo e a crescita lenta può provocare problemi significativi, soprattutto se situato in una zona critica del cervello.
In numerosi individui, un attacco epilettico rappresenta il primo sintomo di un glioma o di un glioblastoma. Le crisi epilettiche, che possono manifestarsi anche per altre patologie, sono provocate da un’attività elettrica disorganizzata nel cervello. Tali episodi possono comportare perdita di coscienza (svenimento), movimenti involontari (convulsioni) e/o perdita del controllo muscolare su tutto il corpo.
Alcune persone manifestano sintomi causati dal gonfiore attorno al tumore (noto come edema cerebrale) o dall’ostruzione del normale flusso del liquido cerebrospinale nel cervello (conosciuto come idrocefalo ostruttivo). In entrambi i casi, i sintomi possono comprendere mal di testa, nausea e vomito, riduzione della coscienza, debolezza o intorpidimento, e perdita di acutezza mentale o difficoltà di concentrazione. L’area del cervello interessata dal tumore e/o dal gonfiore determina i sintomi specifici. Altri sintomi possono essere sintomi cognitivi come perdita di memoria, cambiamento di personalità, confusione, problemi di linguaggio.
DIAGNOSI
La presenza di un tumore cerebrale è solitamente determinata attraverso studi di imaging diagnostico. In caso di sospetto tumore, il medico richiederà una scansione del cervello, utilizzando la risonanza magnetica (RM) o la tomografia computerizzata (TC). La principale differenza tra RM e TC è che la risonanza magnetica utilizza campi magnetici per visualizzare il cervello, mentre la TC impiega raggi X. Entrambi forniscono immagini dettagliate della struttura cerebrale, ma la risonanza magnetica offre generalmente una visione più approfondita del tumore.
La TC è spesso il primo esame prescritto. Tuttavia, la RM fornisce informazioni più dettagliate in caso di sospetto tumore e può essere consigliata dopo la conferma della presenza del tumore. È quasi sempre necessaria nel caso venga consigliato un trattamento chirurgico.
L’unico modo di ottenere una diagnosi definitiva è quella di analizzare un pezzo di tumore, attraverso la sua rimozione o mediante un intervento di biopsia.
TRATTAMENTO
Il trattamento di un glioma o di un glioblastoma deve focalizzarsi sulla gestione dei sintomi e sulla rimozione del tumore. La tempistica e l’approccio ottimali devono equilibrare i benefici terapeutici con il rischio di complicanze.
Gestione sintomatologica
Convulsioni ed edema cerebrale provocare sintomi gravi. Ciascuno di questi disturbi necessita di un trattamento specifico:
- Convulsioni: i farmaci utilizzati per trattare l’epilessia sono generalmente efficaci nel controllare le convulsioni causate dai tumori cerebrali. Tuttavia, nelle persone con tumori cerebrali, soprattutto con gliomi di basso grado, le convulsioni possono risultare più difficili da gestire.
- Edema cerebrale: di solito può essere trattato con successo con steroidi, più comunemente con il desametasone. L’uso di desametasone può essere temporaneo se è previsto un trattamento specifico del tumore, ma può essere particolarmente utile anche nelle fasi tardive della malattia, ad esempio se il tumore recidiva e non c’è altro modo per controllare l’edema cerebrale.
Uno dei principali problemi con l’uso prolungato del desametasone, soprattutto a dosi elevate, è il rischio di effetti collaterali come ulcere, sanguinamento gastrointestinale, alterazioni comportamentali, assottigliamento della pelle, perdita di densità ossea e alti livelli di zucchero nel sangue. Per questo motivo, la dose di desametasone viene progressivamente ridotta fino a trovare la quantità minima efficace per controllare i sintomi, minimizzando così le complicanze a lungo termine.
Trattamento chirurgico
L’obiettivo della chirurgia è rimuovere il maggior numero possibile di cellule tumorali, riducendo al minimo i danni al cervello sano.
I gliomi di basso grado si sviluppano nel tessuto cerebrale normale, rendendo difficile distinguere chiaramente tra tumore e tessuto sano. Pertanto, l’asportazione completa delle cellule tumorali comporta inevitabilmente la rimozione di parte del cervello sano, lasciando spesso cellule tumorali residue invisibili al microscopio chirurgico. Queste cellule residue possono continuare a crescere, causando ulteriori danni al cervello sano e una recidiva dei sintomi. Di conseguenza, anche un intervento chirurgico esteso non garantisce sempre una cura definitiva per i gliomi di basso grado.
Il trattamento chirurgico del glioblastoma prevede la rimozione della massima porzione possibile del tumore attraverso l’intervento. La quantità di tessuto tumorale asportabile dipende dalle dimensioni e dalla posizione del tumore, nonché dal rischio di danneggiare aree cerebrali sane. L’approccio standard consiste nell’asportare il maggior volume di tumore possibile, preservando le aree del cervello responsabili di funzioni vitali.
Il neurochirurgo può essere assistito dalla risonanza magnetica in sala operatoria tramite il neuronavigatore oppure da un colorante speciale che facilita la visualizzazione del tumore al microscopio durante l’intervento. Talvolta, può consigliare una risonanza magnetica cerebrale “funzionale” prima dell’operazione per identificare le aree della corteccia cerebrale responsabili delle varie funzioni neurologiche, come la voce e il movimento. Queste aree possono essere evitate durante la procedura di rimozione del tumore.
Il monitoraggio neurofisiologico intraoperatorio (IONM) è una tecnica che può essere utilizzata durante l’intervento chirurgico per monitorare l’integrità funzionale del sistema nervoso. Questo metodo impiega vari strumenti e tecniche, come l’elettroencefalografia (EEG) e i potenziali evocati, per rilevare e prevenire danni neurologici. L’IONM fornisce informazioni in tempo reale, consentendo di adottare misure immediate per proteggere le strutture nervose critiche, migliorando così la sicurezza e l’esito dell’intervento chirurgico.
Radioterapia
La radioterapia utilizza raggi X ad alta energia che sono accuratamente rivolti all’area del cervello interessata dal tumore. La dose totale di radiazioni, che si basa sul numero di trattamenti e sulla quantità di radiazioni somministrate per trattamento, è attentamente calcolata per massimizzare l’uccisione delle cellule tumorali e ridurre al minimo i danni al cervello normale.
Nelle persone con gliomi di basso grado, la radioterapia può essere raccomandata in tre circostanze:
- Dopo l’intervento chirurgico: la radioterapia può essere somministrata per eliminare le cellule tumorali residue. Tuttavia, l’efficacia immediata post-operatoria non è chiara. Dato l’incertezza del beneficio e il rischio di effetti collaterali neurologici a lungo termine, spesso si preferisce ritardare la radioterapia.
- In caso di glioma di basso grado in un’area critica del cervello: quando il tumore è situato in una zona non operabile e la terapia è considerata necessaria, la radioterapia può diventare il trattamento di scelta.
- In fase avanzata della malattia: se il tumore si ripresenta provocando sintomi, la radioterapia può essere consigliata. L’uso dipende dalla quantità di radiazione già somministrata, poiché normalmente non si può irradiare la stessa area del cervello con dosi complete più di una volta.
Anche quando l’intero tumore sembra essere stato rimosso, quasi tutti i glioblastomi alla fine tornano. Questo perché le cellule tumorali sono cresciute nel cervello normale circostante e non possono essere viste con la risonanza magnetica standard. La radioterapia di solito è sempre raccomandata dopo l’intervento chirurgico.
Un problema significativo della radioterapia sono gli effetti collaterali associati al trattamento. La radiazione colpisce sia le cellule tumorali sia quelle normali, sebbene le cellule tumorali siano leggermente più sensibili. Tuttavia, la radioterapia non può eliminare tutte le cellule cancerose senza danneggiare il tessuto cerebrale sano circostante, causando effetti collaterali.
Chemioterapia
La chemioterapia utilizza farmaci per arrestare o rallentare la crescita delle cellule tumorali, interferendo con la capacità di queste cellule in rapida crescita di dividersi e riprodursi. Poiché la maggior parte delle cellule normali di un adulto non cresce attivamente, esse sono generalmente meno colpite dalla chemioterapia, ad eccezione del midollo osseo (dove si producono le cellule del sangue), dei follicoli piliferi e del rivestimento del tratto gastrointestinale.
La chemioterapia viene spesso combinata con la radioterapia per trattare alcuni tipi di gliomi di basso grado. In altri casi, viene impiegata in fasi successive della malattia, quando il tumore si ripresenta e causa sintomi. Sebbene non sia curativa, la chemioterapia può prolungare la sopravvivenza di alcuni pazienti per diversi anni.
In pazienti selezionati, il restringimento del tumore, spesso accompagnato da un miglioramento dei sintomi, è stato osservato con l’uso di vari farmaci o combinazioni, come la temozolomide o la combinazione “PCV” (procarbazina, lomustina e vincristina). I pazienti con oligodendrogliomi hanno maggiori probabilità di trarre beneficio dalla chemioterapia. Tuttavia, gli effetti collaterali della chemioterapia sono comuni, soprattutto quando si utilizzano più farmaci contemporaneamente (chemioterapia combinata) o dosi elevate.
Se usata in combinazione con la radioterapia e la chirurgia, la chemioterapia può migliorare la sopravvivenza e la qualità della vita in alcuni pazienti con glioblastoma. Il farmaco più utilizzato in questo caso è la temozolomide. La temozolomide viene solitamente assunta per bocca ogni giorno durante il trattamento radioterapico, e poi per un massimo di sei cicli mensili (cinque giorni consecutivi ogni quattro settimane) dopo la radiazione.